Termodinâmica: A entropia
Mas faça-se tudo decentemente e com ordem.
1 Coríntios 14:40
A coluna de hoje é central para diversos temas em discussão de fé e ciência. Mesmo que em algum momento não pareça, todos os assuntos que trato aqui no CosmoTeo estão relacionados com a ponte ou a construção dessa conexão. Espero que ainda tenha sua atenção nessa série (era uma minissérie, mas já está grandinha) sobre Termodinâmica e, principalmente, para o tema que lerá abaixo: a Segunda Lei da Termodinâmica e o ponto central dela, a Entropia. Antes, uma pequena revisão até agora.
Na primeira coluna dessa série tracei alguns conceitos básicos (no sentido de fundamentais) como processos termodinâmicos diversos, calor etc. Um detalhe que merece ser repetido é que a Termodinâmica é uma área da física que nasceu da observação, da experimentação, ainda no séc. XIX; as partes teóricas nasceram posteriormente, principalmente com os desenvolvimentos da mecânica estatística (Boltzmann é o grande nome para este momento) e da física quântica, completamente nascida nas décadas de 1930/40. No mesmo texto ainda comentei sobre a Lei Zero da Termodinâmica: se dois corpos, A e B, estão em equilíbrio térmico com outro corpo C, de forma independente, então A e B estão em equilíbrio térmico entre si. Parece simples esta lei, mas ela é tão fundamental que, historicamente, veio depois das três leis e, conceitualmente, foi para o posto de zero, de primordial ou antecessora das outras.
Na coluna anterior discutimos sobre algumas constantes que são inerentes a cada material: coeficiente de dilatação. Depois, delineei sobre capacidade calorífica, calor específico, transição de fase (importantíssimo!), calor latente e trabalho. Esses conceitos estão intimamente ligados a fenômenos como congelamento de lagos, na superfície, e água líquida com vida em seus interiores: é o que acontece com as luas Encelado (de Saturno) e Europa (de Júpiter); a parte da vida ainda não sabemos se existe por lá. Fechando o texto o texto com a Primeira Lei da Termodinâmica: a variação da energia de um sistema está relacionada com a variação de calor (energia trocada: recebida ou emitida) e com a variação do trabalho (realizado ou sofrido). O cerne dessa lei é a conservação de energia: sistematizada de forma matemática décadas depois, em 1918, por Noether, e generalizada para várias conservações (carga, massa, energia etc), é basilar para o entendimento e, vou além, para a racionalização das leis físicas. Só temos noção de razão ou de padrão imutável das leis físicas se estas puderem ser estudadas e observadas dentro de uma ordem.
Começando o tema de hoje com alguns conceitos. O primeiro dele é sobre processos reversíveis. Pegue um elástico e estique-o, depois, solte-o. O que acontece é: você deu energia para esticar o elástico e, de forma natural, após solta-lo, ele voltou ao estado original. O que aconteceu com a energia (a força de esticar) que deu a ele? Foi transformada: som, aquecimento, desarranjo estrutural (por isso que, com o tempo, os elásticos perdem a elasticidade). Mas, desconsiderando esses detalhes, houve um processo reversível: estiramento e volta ao tamanho normal.
Agora, pegue uma xícara de café quente e deixe-a em cima da mesa: depois de um tempo, o café estará “frio”, ou seja, com a mesma temperatura ambiente. Se você não o reaquecer, jamais terá o café quente. O que aconteceu: o café tinha uma energia térmica que, exposta a um sistema aberto (xícara aberta), transitou (calor) para o meio externo e entrou em equilíbrio térmico com o ambiente. Este é um exemplo de processo irreversível.
Observe que para ambos os processos (reversíveis e irreversíveis) há um caminho, uma forma de acontecerem. Quando o caminho de ida-volta acontece naturalmente, sem a inserção de energia, este processo é reversível. Agora, quando é necessário o acréscimo de energia, o processo é irreversível: café frio (é preciso aquecê-lo) ou um quarto bagunçado (é preciso energia para arrumá-lo).
Veja que até agora não mencionei sobre o tipo de sistema: aberto ou fechado. Revendo o caso do café, não para um sistema aberto (uma xícara em cima de uma mesa na cozinha), mas para um fechado: dentro de uma garrafa térmica. Suponha que essa garrafa seja ideal e esteja, com o café dentro hermeticamente fechada. Isso significa que ela não troca calor (Q) com o meio externo. Inicialmente, o seu interior está com uma temperatura ambiente; coloco um café bem quente e tampo-a. Como ela não troca calor com o meio externo (não há transição de calor de dentro para fora da garrafa), o café, o ar e o interior da garrafa entrarão em equilíbrio térmico depois de um tempo. Isso significa que a temperatura do café variará: como nem todas as moléculas do líquido tem a mesma energia, com o tempo, na média, terão.
Temperatura, como vimos na primeira coluna, está relacionado com o estado de equilíbrio de muitas partículas (ordem de 1023). Indo um pouco mais além, a definição de temperatura é o comportamento das partículas ou moléculas de um sistema a ponto que eu consiga medir, na média, este comportamento por meio da energia: a quantidade medida, na média de energia de um sistema, é a temperatura. Por isso que aprendemos, na escola, que temperatura é o “grau” de agitação das partículas / moléculas de um sistema: com energia, as partículas / moléculas tem movimentação, se chocam entre si, se chocam com as paredes do sistema, aumentam / diminuem as suas velocidades de acordo com o formato do sistema: volume, calor, pressão e constituição das partículas / moléculas (água, algum tipo de gás etc). Um detalhe: temperatura depende diretamente da pressão e do volume do sistema.
Vamos dar uma olhada, dentro da garrafa, as moléculas do café, e vou te mostrar um outro experimento: coloque um café bem quente e um cubo de gelo dentro da garrafa. Depois de um tempo, o gelo fundirá, se transformando em água, e o café diminuirá a sua temperatura. Tudo isso acontecerá e “cessará” ao atingir o equilíbrio térmico, ou seja, a mesma temperatura: na média, todas as moléculas terão uma mesma energia. Como vimos acima, este caso (café e gelo) é um processo irreversível: não importa o tempo que você espere, jamais você terá um café quente e um cubo de gelo, com a estrutura toda certinha, como se tinha antes.
Falando um pouco mais informal. A forma de vida das moléculas / partículas é uma agitação desordenada: não há uma ordem ou um caminho bem definido para todas as moléculas / partículas se movimentarem. Essa aleatoriedade é intrínseca ao sistema. A essa agitação bagunçada, que tem velocidade variável e caminho qualquer (impossível de se definir; lembre-se do princípio de incerteza de Heisenberg), chamarei de grau de desordem. Veja que, com esse conceito de desordem, é possível identificar em todos os sistemas essa bagunça. Ou seja, todo sistema tem, de forma intrínseca, um grau de desordem.
Tomando um sistema fechado, é possível analisarmos esse grau de desordem de várias formas, por exemplo, dividindo-o em volumes menores; quantas vezes quisermos (claro, teoricamente, pois um sistema fechado não troca calor / matéria / massa etc com o meio externo). Se colocarmos, em um sistema fechado, algum tipo de material e este sofre algum processo irreversível, então grau de desordem aumenta. Em outras palavras: em um sistema fechado, se ocorre um processo irreversível, a entropia S do sistema sempre aumenta e nunca diminui.
Entrou uma palavra nova que, intuitivamente, já tínhamos definido: entropia. Este conceito sempre é trabalhado em forma de variação. De forma ainda informal, em um sistema fechado temos um grau de bagunça antes e, depois de um tempo, outro grau de bagunça. Formalmente, em um sistema fechado, a entropia inicial é uma e, depois de um tempo, é outra, se há um processo irreversível.
A partir de agora vou intercambiar variação de entropia e entropia. A entropia pode aumentar ou permanecer constante em um sistema fechado, com um processo irreversível, (observe que, constantemente, estou destacando o termo sistema fechado), nunca diminuir. Vamos ver cada um destes detalhes:
- Diminuir: a entropia em um sistema fechado com um processo irreversível nunca diminui porque o grau de bagunça não tem energia para se organizar ou diminuir a desordem. Para ordenar ou organizar algum sistema é necessário ter acréscimo de energia;
- Permanecer constante: a entropia em um sistema fechado com um processo irreversível pode permanecer constante, por exemplo, após todos os processos termodinâmicos acontecerem. Como é um sistema fechado, não há trocas (de calor, matéria, massa etc) com o meio externo;
- Aumentar: a entropia em um sistema fechado com um processo irreversível aumenta em um sistema fechado pois o grau de bagunça inicial é menor do que o grau de bagunça final (depois dos processos termodinâmicos).

Fonte: https://conhecimentocientifico.r7.com/entropia/
Um exemplo prático: pegue uma xícara de café (um volume de 250 ml) e coloque em uma garrafa térmica (considere-a como um sistema fechado: não troca calor, massa etc com o meio externo), tamanho de 1 litro. Observe que há uma entropia inicial, garrafa e café quente, cada um com temperaturas próprias e diferentes. Depois de colocado o café dentro da garrafa, há um aumento de volume (250 ml para 1 litro). Passado um tempo, a temperatura interna (ar + café + paredes internas da garrafa) estabilizará a uma, ou seja, todos os componentes internos estarão em equilíbrio térmico. E a entropia estará maior. Com mais um tempo, ou seja, depois do equilíbrio térmico, a entropia poderá ser a mesma. Mas, jamais a entropia diminuirá no sistema fechado.

Fonte: https://www.todamateria.com.br/entropia/
Vamos analisar os corpos. A garrafa, inicialmente com uma temperatura ambiente, sofrerá um aumento de entropia: sua temperatura aumenta ao receber muito calor. Com o ar, é análogo. Já o café terá a sua entropia diminuída: ele tem a temperatura decrescida e muita emissão de calor. Veja que estou olhando cada corpo individualmente dentro de um sistema hermeticamente fechado: comparando as entropias inicial e final, veremos que o valor dessa desordem é positivo, ou seja, a entropia final é maior do que a inicial. Escrevendo em equação:
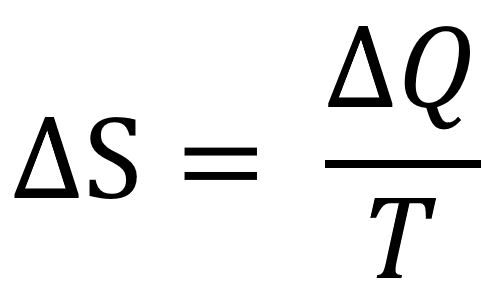
Calma, não se assuste com essa equação; nem é necessário você saber o que cada coisa escrita significa. Explico para você cada parte abaixo:
- ΔS = é a variação de entropia (S) final e entropia inicial. A variação pode ser negativa / positiva ou zero (diminuição / aumento de entropia no fim dos processos ou constante);
- ΔQ = é a variação de calor (Q) trânsito de energia do sistema;
- T = temperatura.
Em resumo: a variação de entropia de um sistema é dada pela soma de cada pedacinho (infinitesimal) do calor e dividido pela temperatura.

Fonte: https://mundoeducacao.uol.com.br/fisica/entropia-uma-grandeza-termodinamica.htm
Sei que há muita informação, mas resumirei. Em muitos momentos pode até parecer que estou sendo prolixo demais, mas isso é intencional: quero que você entenda alguns conceitos, de forma simples, a ponto de conectar o que acontece na natureza com a teologia ou, no mínimo, não ver contradições entre os 2 livros de Deus. Em tópicos:
- Processos reversíveis: processos que podem voltar ao formato inicial naturalmente. Exemplo: elástico e mola;
- Processos irreversíveis: processos que não voltam ao formato inicial naturalmente, sendo necessário acréscimo de energia. Exemplo: café quente que esfria e um copo que se quebra;
- Sistema aberto: é um tipo de sistema que tem trocas: calor, massa etc. Exemplo: a Terra, que recebe energia do Sol e partículas do espaço;
- Sistema fechado: é um tipo de sistema que não tem trocas: calor, massa etc. Exemplo: garrafa térmica ideal.
- Entropia: é uma propriedade física que está relacionado com a energia de um sistema. Lembre-se que calor é trânsito de energia e temperatura, é uma medida macroscópica desta;
- Variação de entropia: é a subtração da entropia inicial e final de um sistema. Essa expressão pode ser positiva, negativa ou nula;
- Variação de entropia em um sistema fechado: em um sistema em que não há trocas (calor, massa etc) a variação da entropia sempre aumenta ou permanece constante, nunca diminui. Mas, internamente, os corpos podem ter entropia diminuída, aumentada ou constante. Já a variação de entropia do sistema, como um todo, sempre aumenta ou permanece constante, nunca diminui.

Fonte: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm
E o que tudo isso, que parece complicado demais, tem equações, gráficos etc, tem a ver com a teologia? Sem entrar em todos os detalhes: caos e ordem estão no início do texto bíblico. Veja que o texto começa com Deus criando tudo e, já no verso 2 de Gênesis 1 há uma expressão que denota isso: sem forma e vazia. No original hebraico essas duas palavras tem a ideia de que o “universo” (Israel só tinha ideia de Terra plana, estrelas fixas etc) nasceu de um caos primordial: a semana da criação, relatada no capítulo 1 de Gênesis, é Deus colocando ordem no meio do caos e dando funcionalidade. Um dia ainda explorarei mais esses pontos, mas o cerne da questão é que tudo começa com caos e Deus ordena e dá função a tudo.
E a terra era sem forma e vazia; e havia trevas sobre a face do abismo; e o Espírito de Deus se movia sobre a face das águas.
Gênesis 1:2
Só isso?! Sim! Mas, ficou em dúvida, quer perguntar algo, deixar algum comentário ou sugerir algum tema, deixe abaixo! Ficarei feliz em te responder, seja nos comentários ou em algum artigo específico.
Sugestão de leitura
Para essa minissérie estou utilizando os livros abaixo. O nível deles é de início de graduação à pós, inclusive estudei em dois deles no doutorado:
- Termodinâmica, por Mário José de Oliveira, 2ª edição revista e ampliada, editora Livraria da Física;
- Foundations of statistical mechanics: a deductive treatment, por Oliver Penrose, editora Pergamon Press. Oliver Penrose é irmão do físico Roger Penrose, que ganhou o Nobel de Física este ano, 2020, pelo desenvolvimento matemático com a RG sobre os buracos negros;
- Introduction to statistical physics, por Kerson Huang, editora Taylor & Francis;
- Introdução à física estatística, por Sílvio Salinas, editor EdUSP. Prof. Salinas é uma referência em física estatística no Brasil;
- Fundamentos de física: gravitação, ondas e termodinâmica, por Halliday, Resnick e Walker, vol. 2, 7ª edição, editora LTC. É o tradicional livro (ou coleção: são 4 volumes no total) introdutório a física para quem quer algo a mais do que aprendeu no ensino médico ou está entrando na faculdade;
- Curso de física estatística, por Torsten Fließbach (ß tem um som ou pode ser transliterado por ss: Fliessbach), editora Fundação Calouste Gulbenkian.
As recomendações de leitura, que não são acadêmicas:
- Livro Astronomia e astrofísica, por S. O. Kepler e Maria de Fátima Saraiva. Este livro é disponibilizado no próprio site dos autores, que são professores da UFRGS. É um excelente material de consulta: http://astro.if.ufrgs.br/livro.pdf;
- Livro Alfa e Ômega: a busca pelo início e fim do universo, por Charles Seife, editora Roccomn. É um livro de 2007, está um pouquinho desatualizado com relação a dados (como bóson de Higgs e ondas gravitacionais), mas ainda é muito proveitoso e com uma didática muito boa;
- Livro Cosmologia física: do micro ao macro cosmos e vice-versa, por Jorge Horvath, German Lugones, Marcelo porto, Sergio Scarano e Ramachrisna Teixeira, editora Livraria da Física. Outro livro muito bom, um pouquinho técnico, mas nada que não possa ser resolvido por si mesmo. Está um pouquinho desatualizado com relação a dados por ser de 2011, porém, altamente recomendado;
- Prof. Alexandre Zabot, da UFSC, tem um curso gratuito de astrofísica geral excelente. Recomendo fortemente. Você assiste as aulas no YouTube, tem acesso ao material (slides, sites e alguns textos). Para todas as informações, links das aulas e materiais: https://astrofisica.ufsc.br/astrofisica-geral/.